Forschende des BIH entschlüsseln Mechanismen der Leberregeneration
Ludovic Vallier züchtet Mini-Lebern, so genannte Organoide, um zu erforschen, wie Erkrankungen der Leber entstehen und wie sie behandelt oder verhindert werden können. Er ist Einstein-Professor für Stammzellen in regenerativen Therapien am Berlin Institute of Health in der Charité (BIH) und Max-Planck-Fellow am Max-Planck-Institut für Molekulare Genetik. Langfristig möchte er die Leberorganoide auch für zellbasierte Therapien für Patient*innen mit Leberversagen einsetzen.
Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD) und ihre chronische Form Metabolic Dysfunction-Associated Steatohepatitis (MASH) - also eine Verfettung der Leber sind die häufigste Ursache von Lebererkrankungen. Trotz jüngster Fortschritte besteht die einzige Behandlung für MASH im Endstadium in einer Lebertransplantation, die mit einer starken immunsuppressiven Behandlung verbunden ist. Jedoch kann nur eine begrenzte Anzahl von Patient*innen von dieser Therapie profitieren, da es an Organspender*innen mangelt. Mit diesem Thema beschäftigten sich nun Dr. Chris Gribben und Dr. Vasileios Galanakis aus dem Team Vallier im Rahmen eines Open Targets Projekts zusammen mit Dr. Irina Mohorianu (Wellcome-MRC Cambridge Stem Cell Institute an der Universität Cambridge) und Dr. Michael Allison (NHS Addenbrooke's TrusT). "Es ist überraschend, wie wenig wir über die Mechanismen wissen, die beim Fortschreiten der Krankheit beim Menschen ablaufen. Das liegt daran, dass die Erforschung einer Krankheit, die Jahrzehnte dauern kann, bis sie sich vollständig entwickelt, sehr schwierig ist. Die erforderliche Technologie ist erst seit kurzem verfügbar”, sagt Vallier.
Chronische Verletzungen verändern die Architektur der Leber grundlegend
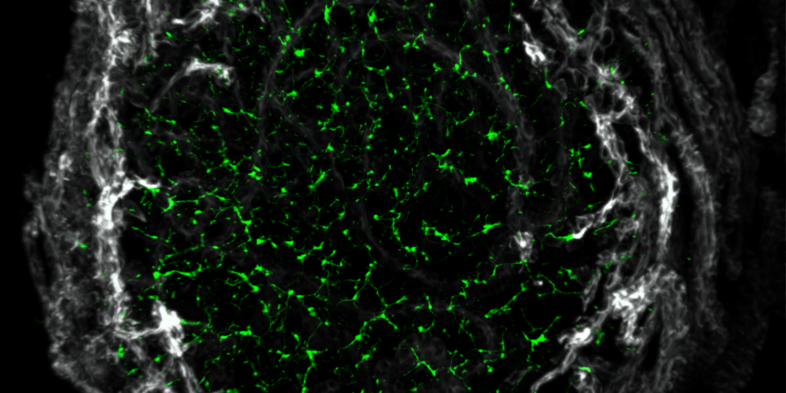
Die Wissenschaftler entnahmen kleine Stücke der Leber (Biopsien) von Patient*innen, die sich in der MASH-Klinik am Addenbrooke's Hospital in Cambridge UK einer Diagnose unterzogen. Anschließend führten sie Einzelzellanalysen durch, um die zugrunde liegenden Mechanismen zu ermitteln. Die Biopsien stammten von Patient*innen in verschiedenen Krankheitsstadien, sodass sich erstmals das Fortschreiten der MASLD beim Menschen darstellen ließ. Sie entdeckten einen interessanten Mechanismus: Chronische Leberschäden veränderten die Leberarchitektur stark, insbesondere die Struktur der drei Gallengänge - ein Netz von Leitungen, die die Leber von Giftstoffen entwässern. Diese Umstrukturierung ist mit einem Regenerationsprozess verbunden, der als Transdifferenzierung bezeichnet wird.
"Wir wussten, dass das Fortschreiten der Krankheit eine Proliferation der Cholangiozyten, der Hauptzellart der drei Gallengänge, auslösen kann. Wir haben jedoch nicht erwartet, dass diese Proliferation organisiert abläuft und zur Bildung eines so komplexen Netzwerks führt, das die Architektur der Leber stark beeinträchtigt", berichtet Vallier.
Das Fortschreiten der Krankheit geht mit Zeichen der Regeneration einher
"Nun wollten wir natürlich wissen, ob dieser Prozess ein Zeichen dafür ist, dass die Leber versucht, sich selbst zu reparieren oder dass die Schädigung fortschreitet. Dazu haben wir detaillierte Einzelanalysen durchgeführt und festgestellt, dass Cholangiozyten offenbar in Hepatozyten, den wichtigsten funktionellen Zelltyp der Leber, transdifferenzieren. Das Organ versucht also verzweifelt, die funktionellen Zellen zu ersetzen, die während der Krankheit absterben", erklärt Vallier.
Die Frage war nun, welche Mechanismen hinter diesem Regenerationsprozess stecken. "Wir hatten das große Glück, eng mit der Bioinformatikerin Dr. Irina Mohorianu und ihrem Team zusammenzuarbeiten”, sagt Vallier. ”Gemeinsam konnten wir eine Liste von Faktoren erstellen, die während der Transdifferenzierung zwischen Cholangiozyten und Hepatozyten hochreguliert werden. Diese Faktoren konnten wir in Gewebeproben von weiteren Patienten validieren. Interessant ist, dass Insulin eine wichtige Rolle spielen und so relevant für die zukünftige therapeutische Entwicklung sein könnte.
Das Prinzip funktioniert auch in in vitro gezüchteten Organoiden...
Schließlich verwendeten die Forscher*innen Cholangiozyten-Organoide von Patient*innen mit fortgeschrittener MASLD. Diese Miniorgane können in vitro fast unbegrenzt gezüchtet werden und behalten dabei die für die Modellierung der Krankheit relevanten Funktionen bei. Und tatsächlich: Cholangiozyten-Organoide können auch in vitro in hepatozytenähnliche Zellen transdifferenzieren. Dieser Prozess konnte durch Hemmung bzw. Verstärkung des Insulinweges blockiert oder gefördert werden. "Wir konnten somit zeigen, dass molekulare Mechanismen, die beim Menschen über einen längeren Zeitraum auftreten, in vitro untersucht werden können", sagt Ludovic Vallier. Die Ergebnisse deuten aber auch auf einen weiteren Aspekt der Organregeneration hin.
...und diese Ergebnisse könnten auch für Leberkrebs relevant sein.
Die meisten Transdifferenzierungsvorgänge finden in der letzten Phase der Krankheit statt, wenn die Leber stark geschädigt ist. Dieser Regenerationsprozess ist also mit dem Fortschreiten der Krankheit verbunden und scheint nicht direkt durch eine Verletzung ausgelöst zu werden. Darüber hinaus sind Lebererkrankungen im Endstadium stark mit Leberkrebs verbunden, während eine Reihe von Faktoren, die die Transdifferenzierung in vivo und in vitro zu fördern scheinen, auch in Lebertumoren stark ausgeprägt ist. Demnach könne Krebs aus einem schief gelaufenen Regenerationsprozess entstehen. In der Tat könnten chronische Verletzungen und eine kranke Mikroumgebung eine große Menge an Stress auf die Zellen ausüben, die dann "plastisch" werden und somit in der Lage sind, zu transdifferenzieren. Dieser Erwerb von Plastizität könnte jedoch abnormal werden, wenn er zu weit geht.
Entscheidend ist das Gleichgewicht zwischen Regeneration und Tumorentstehung
Diese Studie zeigt, dass sich menschliche Organe auch nach langwierigen Krankheiten und wiederholten Verletzungen regenerieren können. Der Prozess ist jedoch riskant und kann schief gehen. Die Kontrolle des Erwerbs der zellulären Plastizität ist von entscheidender Bedeutung. Diese Erkenntnis lenkt den Blick auf neue Aspekte der Pathophysiologie chronischer Lebererkrankungen. Dazu gehört die Entdeckung neuer Signalwege, die das Gleichgewicht zwischen Krankheitsprogression und Gewebereparatur steuern, sowie die Identifizierung neuer Biomarker für Diagnose und Prognose.
"Wir sind natürlich begeistert von diesen Ergebnissen", berichtet Ludovic Vallier, "denn wir glauben, dass wir einen Weg zu neuen Therapien gefunden haben, die nicht nur das Fortschreiten der Krankheit begrenzen, sondern stattdessen darauf abzielen, die Gewebereparatur zu fördern. Natürlich müssen wir noch weiterarbeiten, bevor sich diese Erkenntnisse auf die Klinik auswirken, aber dies ist ein wichtiger erster Schritt. Wir können uns nun auf die Entwicklung neuer Therapien einschließlich zellbasierter Ansätze konzentrieren, die den Patienten helfen können. Und das ist unser Ziel!"
Originalpublikation
Gribben, C., Galanakis, V., Calderwood, A. et al. Acquisition of epithelial plasticity in human chronic liver disease. Nature (2024). doi.org/10.1038/s41586-024-07465-2
https://www.nature.com/articles/s41586-024-07465-2



